ENLACES IÓNICOS
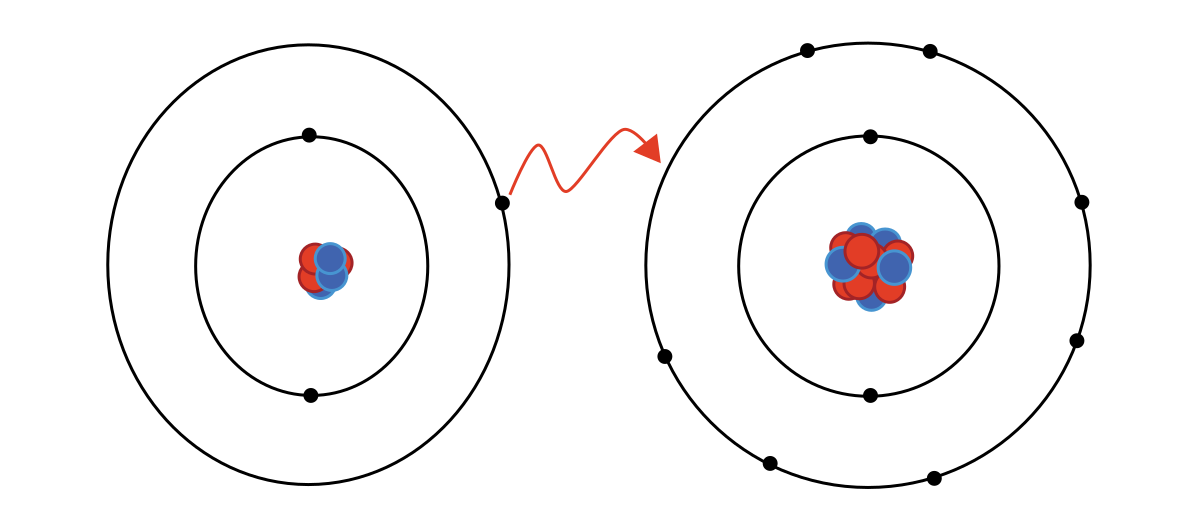
los enlaces químicos, los átomos pueden transferir o compartir sus electrones de valencia. En el caso extremo en que uno o más átomos pierden electrones, y otros átomos los ganan con el fin de producir una configuración de electrones de gas noble, el enlace se denomina enlace iónico.
Es decir, un átomo pierde electrones y otros ganaran produciéndose una fuerza electrostática
compuestos iónicos
- Son sólidos cristalinos, de estructura muy ordenada, en forma de red.
- Punto de fusión elevado, por lo general más de 400 º C. Esto es consecuencia de la fuerza de atracción que une los iones cuando se encuentran formando la red cristalina.
- Las uniones por fuerza electrostática se rompen con facilidad al agregar un solvente polar, agua por ejemplo, disolviendo el compuesto, obteniéndose los aniones y cationes por separado.
configuración electrónica
La Configuración o Distribución electrónica nos dice cómo están ordenados los electrones en los distintos niveles de energía (órbitas), o lo que es lo mismo cómo están distribuidos los electrones alrededor del núcleo de su átomo
Particulas subatomica
cuando trabajamos con la configuraciones electrónica de un elemento la partícula principal son los electrones
PRINCIPIO DE AUFBAU
El llenado de los subniveles energéticos se efectúa desde los que tiene menor energía hacia los de mayor energía.
ORDEN ENERGÉTICO DE LOS SUBNIVELES
Energía relativa de un subnivel (E) se determina con la siguiente fórmula
E=N+E
donde
N=valor del número cuántico principal
E=valor de l numero cuántico secundario
EJEMPLOS DE CONFIGURACIÓN ELECTRÓNICA
Calcio 20 = 1s2 2s2 2p6 3s2 3p6 4s2
plata 47=1s2 , 2s2, 2p6, 3s2, 3p6 , 4S2, 3d10, 4p6, 5s2 , 4d9
Energía relativa de un subnivel (E) se determina con la siguiente fórmula
E=N+E
donde
N=valor del número cuántico principal
E=valor de l numero cuántico secundario
7P
6D
5F
7S
6P
5D
4F
6S
5P
4D
5S
4P
3D
4S
3P
3S
2P ↑
2S
1S ENERGÍA
PRINCIPIOS DE EXCLUSIÓN DE PAULI
electrones en un átomo no pueden tener idéntico número cuántico. Este es un ejemplo de un principio general que se aplica no sólo a los electrones, sino también a otras partículas de espín medio-entero
SUBNIVEL
|
NÚMERO MÁXIMO DE ELECTRONES
|
S
|
2
|
P
|
6
|
D
|
10
|
F
|
14
|
Calcio 20 = 1s2 2s2 2p6 3s2 3p6 4s2
plata 47=1s2 , 2s2, 2p6, 3s2, 3p6 , 4S2, 3d10, 4p6, 5s2 , 4d9


No hay comentarios:
Publicar un comentario